磷氧化物(三氧化二磷是亚磷酸的酸酐)
- 电商
- 2022-06-12 12:44:50
磷的氧化物都有哪些
磷是磷和氧结合的产物,是一种化合物。元素磷有几种同素异形体。其中,白磷或黄磷是无色或淡黄色透明结晶固体。密度为1.82克/立方厘米。熔点44.1,沸点280,燃点40。它在黑暗中发出磷光。太臭了。剧毒。白磷几乎不溶于水,但易溶于二硫化碳溶剂。高压下加热会变成黑磷,密度2.70g/cm3,略带金属味。电离能是10.486电子伏特。不溶于普通溶剂。白磷在400下静置或加热数小时可转化为红磷。磷为红棕色粉末,无毒,密度2.34 g/cm3,熔点59,沸点200,燃点240。不溶于水。在自然界中,磷以磷酸盐的形式存在,是生命的重要元素。它存在于细胞、蛋白质、骨骼和牙齿中。在含磷化合物中,磷原子通过氧原子与其他原子或基团相连。
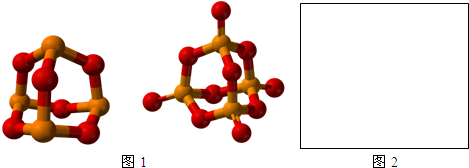
磷的氧化物都有什么?
广义的氧化物是指由氧和另一种化学元素组成的二元化合物,如二氧化碳(CO)和氧化钙(CaO)。而电负性较大的氧和氟结合形成的化合物,一般不叫氧化物,叫氟化物。五氧化二磷酸酐——五价——磷酸。三氧化二磷酸酐——三价3354亚磷酸。一价次磷酸的氧化磷——酸酐。

磷的含氧化物的性质有哪些
广义的氧化物是指由氧和另一种化学元素组成的二元化合物,如二氧化碳(CO)和氧化钙(CaO)。而电负性较大的氧和氟结合形成的化合物,一般不叫氧化物,叫氟化物。磷化氢PH3是一种无色剧毒气体,气味类似大蒜。磷化氢也叫磷化氢。PH3在183.28K凝结成液体,在139.25K凝结成固体,PH3在水中的溶解度远小于NH3,在290K时,每100dm3的水可以溶解26dm3。PH3水溶液的碱性也比氨水弱。生成的水合物PH3 H2O,它相当于NH3 H2O的类似物。因为鏻盐容易水解,所以水溶液中没有PH4,生成的PH3从溶液中逸出。(1)PH3中P的氧化数为-3,从其标准电极电位来看,PH3是强还原剂。在AgNO3溶液中引入pH 3时,Ag沉淀,在CuSO4溶液中引入PH3时,有磷化亚铜Cu3P和Cu沉淀。PH3在空气中的燃点为423K,在空气中燃烧生成磷酸,也显示了它的强还原性。(2)与NH3类似,PH3及其取代衍生物PR3能与过渡元素形成多种配位化合物,其配位能力比NH3或胺强得多。因此,PR3不仅提供配位电子,而且配合物的中心离子可以将电子反馈到磷原子的空D轨道上。增强了配位离子的稳定性。比如CuCl PH3,PTCl 2 2p (CH3) 3等。(3)PH3在空气中能自燃,因为这种气体中往往含有较活泼的、容易自燃的二膦P2H4,它是肼N2H4的类似物。磷在室温下或空气不足时可缓慢氧化,生成P(III)的氧化物P4O6。P4O6的形成,通常称为三氧化二磷,可以看作是P4分子的形成。P4分子中的P-P键由于O2分子的攻击而断裂。在每个P原子上插入一个O原子形成P4O6分子后,四个P原子(正四面体的角)的相对位置不变。因为三氧化二磷的分子具有球形结构,很容易滑动。所以三氧化二磷是一种白色的吸湿蜡状固体,有滑腻感,熔点296.8K,沸点(氮气气氛下)446.8K三氧化二磷有剧毒,溶于冷水中缓慢生成亚磷酸。这是磷酐。P4O6 6H2O(冷水)4H3PO4三氧化二磷在热水中歧化生成磷酸,释放磷化氢。P4O6 6H2O(热水)3 h3po 4PH3白磷在充足的氧气中燃烧可以生成P4O10,通常简称P2O5。在氧化数为5的球形分子中。P4O6,每个P原子上有一个孤电子对。配位到氧原子的空P轨道上,与氧结合形成P4O10分子。P4O10分子中有6个桥氧和4个末端氧,末端氧与磷的化学键可视为双键。五氧化二磷为白色粉末状固体,熔点693k和573k升华。在空气中有很强的吸水性和潮解性,所以是最强的干燥剂。五氧化二磷与水有很强的相互作用。产生P ()的各种含氧酸不能立即转化为磷酸,只有在HNO3存在下煮沸才能转化为磷酸。五氧化二磷是磷酸的酸酐。氧化的酸和磷的盐。磷可以生成各种氧化值的含氧酸和盐。含氧酸和P ()盐是最重要的。以下几种磷的重要含氧酸:名称正磷酸焦磷酸三磷酸偏磷酸次磷酸盐化学式h3po 4p 2 o 7 H5 p3o 10(HP O3)nh3po 3 h3po 2氧化态V V V V III I参考文献:http://ccce.henu.e.cn/inor/dzja/chapter16/chapter16-3.htm
上一篇:铬氧化物(金属铬的特性)
下一篇:硒氧化物(什么是硒元素)
- 人参与,0条评论
发表评论