医疗器械产品认证(医疗器械认证体系)
- 电商
- 2022-07-11 03:28:15
医疗器械需要什么认证?
一般医疗器械在国内生产销售的,只需要营业执照、生产许可证(第一类产品除外)和产品注册证。在申请产品注册过程中,我局将对企业的质量和数量管理体系进行评估或对生产实施细则进行审核,并出具评估报告。其他认证(如CE、FDA、ISO13485)是自愿的,但如果是国家CCC强制认证目录上的产品。

医疗器械产品认证需要什么认证?
购买医疗器械连锁产品,应该检查哪六个证书?(1) 《医疗器械生产企业许可证》(二、三类医疗器械生产企业);(2) 《医疗器械产品注册悄指证》 ;(3)从事该产品的企业《医疗器械经营企业许可证》(指从事十三种二类产品以外的二类、三类产品的企业);(4)产品合格证;(5)3C认证(《实施强制性产品认证的产品目录》的所有医疗器械都要有3C认证和标识);(6)EMC证书(指医用电气设备)。…厦门福瑞达医疗器械咨询公司真诚为您服务。

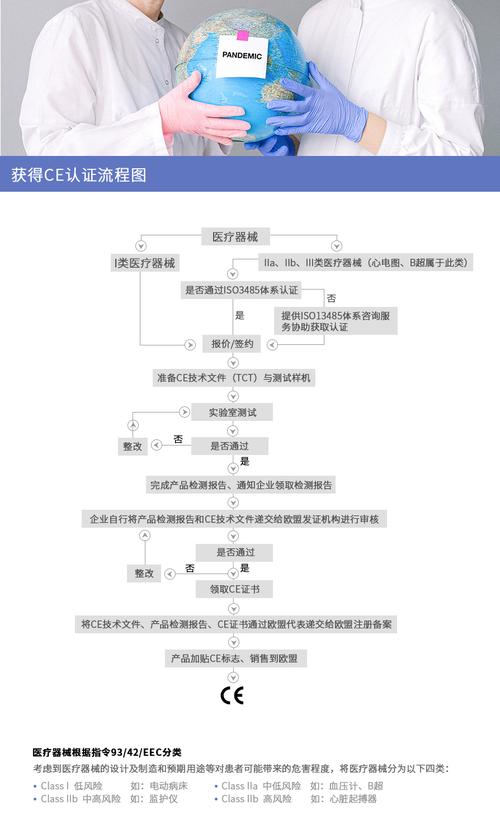
医疗器械产品认证CE认证怎么做,流程
要顺利通过CE认证,需要做好三个方面的工作。首先,收集与认证产品相关的欧盟技术法规和欧盟(EN)标准,并消化、吸收、纳入企业产品标准。二是企业严格按照上述产品标准组织生产,即在产品设计、开发和制造的全过程中贯彻上述技术法规和EN标准的要求。第三,企业必须按照ISO9000 ISO13485标准建立和保持质量体系,并获得ISO9000 ISO13485认证。获得ce标志的一般程序目前国内一些医疗器械生产企业(尤其是一些乡镇企业)对医疗器械说明书了解不多,不知道如何申请CE标志。为此,我们简单介绍一下获得ce标志所需的步骤如下:第一步。分析设备及其特性,以确定其是否在指令范围内。指令中明确定义了医疗设备的定义。有些产品看起来像医疗设备,如按摩器和口罩。其实不在医疗器械说明书的范围内。第二步。确认适用的基本要求。根据指令,任何医疗器械都必须满足指令附录I中规定的预期用途,因此制造商首先也是最重要的是确认适用于其产品的所有基本条件。第三步。确认任何相关的欧洲协调标准都是由欧洲标准委员会(CEN)和欧洲电工委员会(CENELEC)制定并在欧盟官方刊物上发布的标准。对于某种医疗器械,可能有多种适用的协调标准。因此,我们正在确认哪些协调标准适用于它。因此,在确认哪些协调标准适用于某种产品时,我们应该非常小心。第四步。确保产品满足基本要求或协调标准的要求,并记录证据。制造商应能提供足够的证据(如公告机构或其他检验机构根据协调标准进行的检验等。)来证明产品符合基本要求。第五步。产品分类根据指令附录ix中的分类规则,医疗器械分为四类,即A和B.127而且不同类型的产品有不同的途径(合格评定程序)获得CE标志。因此,对于制造商来说,准确地确定其产品的类型是非常重要的。第六步。确定相应的合格评定程序。对于a类、B类和类医疗器械的生产企业来说,存在一个如何选择符合评价程序的方式的问题。主要区别是选择崩稿和型式试验的配方还是质量体系的方式。这两种方式各有特点。厂商要根据自己的实际情况选择最适合的方式。第七步。选择公告代理。对于A类、B类和类医疗器械,以及无菌或有测量功能的类医疗器械,应选择公告机构,并进行符合性评价程序。在欧盟官方期刊公布的公告机构名单中,对每个公告机构可以从事的医疗器械认证和符合性评价程序都有严格的规定。厂商在选择公告机构时一定要非常谨慎,避免不必要的损失。第八步:起草符合性声明并贴上CE标志可以说符合性声明是一份重要的文件。每个设备必须包括医疗设备指令附录中描述的一致性声明。
下一篇:移动登车桥(移动卸货平台登车桥)
- 人参与,0条评论
发表评论