均相催化反应催化剂(非均相催化剂)
- 电商
- 2022-06-19 21:23:06
什么是均相催化剂和非均向催化剂
加快催化剂反应速率的原因与温度对反应速率的影响有着根本的不同。催化剂可以改变反应路线,降低反应活化能,增加反应物分子中活化分子的百分比,加快反应速率。催化可分为均相催化和多相催化。如果催化剂和反应物都处于气态或液态,则为均相催化。如果催化剂是固体,当反应物处于气态或液态时,称为多相催化。在均相催化中,催化剂通常与反应物分子或离子结合形成不稳定的中间体,即活化络合物。这一过程的活化能通常较低,所以反应速率较快,然后中间体与另一种反应物快速反应(活化能也较低)形成最终产物。并再生催化剂。这个过程可以表示为:A B=A B(慢)A C=AC(快)AC B=AB C(快),其中A和B是反应物,AB是产物,C是催化剂。由于反应路径发生了变化,一步反应分为两步,两步反应的活化能之和远远高于一步反应。催化剂是一种固体物质,固体催化剂表面有一些特殊的活性中心,可以吸附反应物分子,称为活化中心。反应物在催化剂表面的活性中心形成不稳定的中间化合物,从而降低原反应的活化能,使反应快速进行。催化剂的表面积越大,其催化活性越高,所以催化剂通常被制成细颗粒或附着在多孔载体上。许多工业生产都使用这种多相催化剂,如石油裂解、氨合成等。并使用大量金属氧化物固体催化剂。这个理论被称为“激活中心理论”。催化剂能同等程度地加速正负反应,但不能移动化学平衡,改变反应物的转化率。请注意,加速逆反应意味着减慢反应速率。
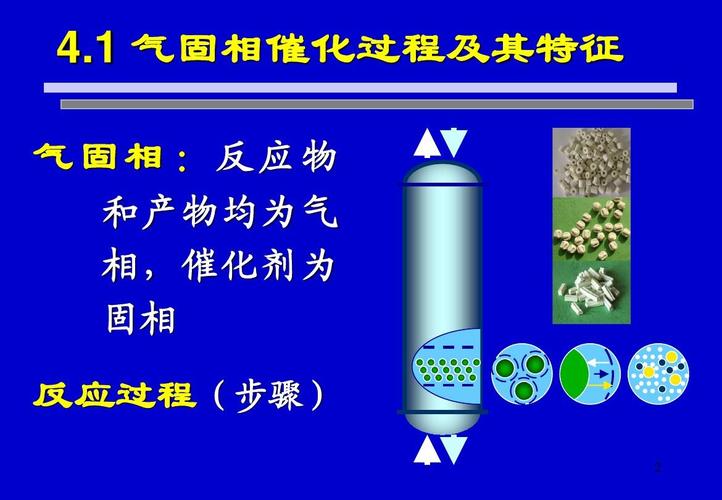
什么是非均相催化剂?什么是均相催化剂?
催化可分为均相催化和多相催化。如果催化剂和反应物都处于气态或液态,则为均相催化。如果催化剂是固体,反应物是气体或液体,则称为多相催化。
均相催化剂和多相催化剂有哪些优缺点?及其异同之处有哪些
1.高活跃度;2.选择性好。3.可以在分子水平上分析催化机理。补充:均相催化顾名思义就是底物和催化剂同时存在于同一个体系(例如溶液)中。一般来说,由于接触表面积大,催化剂利用率高,催化效果好。通常,多相催化是基质和催化剂之间的相界面。一般来说,底物产物混合物可以在反应后通过多相催化(如吸附、固定化、键合到高分子树脂链上、水-有机两相反应等)与催化剂本身分离。)或直接使用非均相催化剂,实现催化剂的循环使用,有效降低工业生产成本。但均相催化剂的多相催化一直是应用化学中的难点,因为均相催化的机理与多相催化相似,但本质上有很大不同。无论采用哪种方法进行多相催化,其化学微环境仍会发生变化,导致催化活性和选择性下降。同时,多相催化后如何稳定均相催化剂也是该研究方向遇到的一个重要问题,即如何防止催化剂的活性组分重新溶解到体系中,造成催化剂的流失。目前,一些以多相催化形式存在的催化剂比其他催化剂更有效,而多相催化后,均相催化剂的活性和选择性很难再现。更能让人接受的是微量催化法,即用万分之一等极少量的催化剂直接进行均相反应,反应后不进行分离,具有高活性和高选择性。ppm甚至ppb级的残留物已经满足产品纯度标准,而催化剂的成本由于催化剂的用量少而非常低。
上一篇:化肥催化剂(生产化肥的主要原料)
- 人参与,0条评论
发表评论