其他炔烃(炔烃的反应)
- 电商
- 2022-06-12 20:54:18
炔烃的知识,谁能给我讲讲
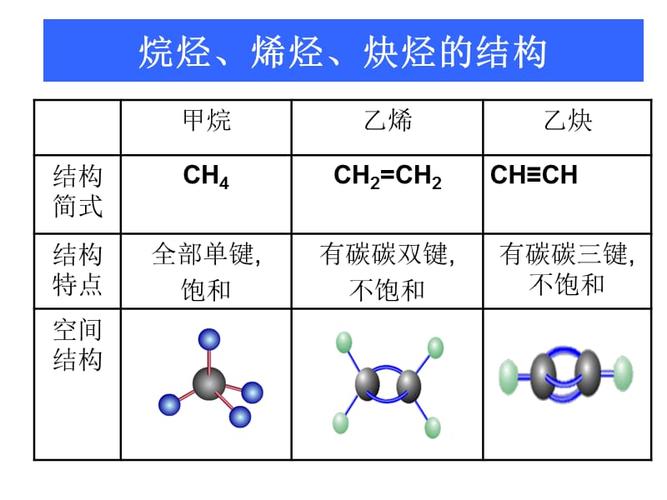
炔烃炔烃,分子中含有三个碳碳键的碳氢化合物的总称,是一种不饱和烃。简单的炔烃化合物包括乙炔(C2H2)、丙炔(C3H4)等。工业乙炔被用作焊接的原料。中文名炔烃官能团C-C三键分子通式CnH2n-2(其中n为1以外的正整数)1炔烃简介编辑炔烃(拼音:qutng;炔烃是一种有机化合物,属于不饱和烃。它的官能团是碳碳三键(-c c-)。通式CnH2n-2,其中n是等于2的正整数。简单炔烃包括乙炔(C2H2)、丙炔(C3H4)等。本来乙炔也叫乙炔气,乙炔气通常用来指乙炔,乙炔中最简单的乙炔。“炔”字是新造的字,同音(qu),左边的火取自“碳”字,表示能燃烧;右边的勾号取自“缺”字,表示氢原子数和化合价比烯烃更缺,表示炔烃是烷烃(完全)和烯烃(稀有)的不饱和衍生物。简单炔烃的熔点、沸点和密度都高于相同碳原子数的烷烃或烯烃。不溶于水,溶于乙醚、苯、四氯化碳等有机溶剂。炔烃可以通过加成或聚合与卤素、氢、卤化氢和水反应。因为乙炔燃烧时放出大量的热量,所以乙炔常被用作焊接原料。2炔烃轨道编辑炔烃碳原子的2S轨道与2P轨道杂化形成两个相同的SP杂化轨道。堆叠在碳原子的两侧,它们之间的角度是180度。乙炔原子的一个SP杂化轨道与氢原子的1S轨道形成烃键,另一个SP杂化轨道与相连碳原子的SP杂化轨道形成碳碳键,形成线型乙炔分子。两个未杂化的P轨道和另一个碳的两个P轨道相互平行并并排重叠,形成两个相互垂直的键。3分子结构编辑器分子中含有碳碳三键的碳氢化合物的总称,碳氢化合物。炔烃是一种具有碳碳三键的脂肪烃。4物理性质编辑炔烃熔点低,密度小,难溶于水,易溶于有机溶剂,一般随着分子中碳原子数的增加而逐渐变化。炔烃在水中的溶解度略大于烷烃和烯烃。乙炔、丙炔和1-丁炔极性较弱,微溶于水,但在非极性溶液中易溶于碳骨架相同的炔烃,链端三键极性较低。炔烃有偶极矩,烷基分支多的炔烃更稳定。5化学成分编辑第二次世界大战期间,德国化学家J.W .裴蕾发明了乙炔在高温高压下安全反应的技术,并合成了许多重要产品,使乙炔成为一种基本的有机原料。乙炔的使用已逐渐被乙烯和丙烯所取代。最简单的炔烃是乙炔。其结构式为CH CH,分子中的四个原子在一条直线上。CC和C-H的键长分别为1.205埃和1.058埃,比乙烯分子中C=C和C-H的键长要短。根据量子化学的描述,乙炔分子中的两个碳原子以sp杂化轨道相互重叠,再以sp杂化轨道与两个氢原子的1s轨道重叠,形成三个键(一个C-C键和两个C-H键)。两个碳原子上各剩下一个2py和2pz轨道,它们在相互垂直的方向上相互重叠,形成两个键。因此,三键由一个键和两个键组成。因为C-C-C结构单元中的四个碳原子在一条直线上,三键的存在不会产生几何异构体,三键碳原子上也不能有侧链,所以炔烃异构体的数量比相同碳原子数的烯烃少。6特性编辑器相对蒸汽密度:(空气=1): 0.91。蒸汽压(kPa): 4053 (16.8)。闪点-50。燃烧热:1298.4kJ/mol键能:837kJ/mol稳定性和反应性:不稳定,非常活跃。禁用化合物:强氧化剂、强酸、卤素。要避免的情况
简单炔烃的沸点、熔点和密度一般高于相同碳原子数的烷烃和烯烃。这是因为炔烃分子又短又小又细长。在液态和固态下,分子之间可以相互靠近,分子之间的范德华力很强。炔烃分子的极性略大于烯烃。烯烃不溶于水,但溶于石油醚、乙醚、苯和四氯化碳。结构鉴定乙炔通入银氨溶液或亚铜氨溶液中,分别析出白色和红棕色的乙炔化物沉淀。其他末端炔烃也有上述反应,因此分子中所含的—CCH基团可以通过上述反应进行识别。和炔烃的氧化反应一样,可以根据高锰酸钾溶液的颜色变化来鉴别炔烃,根据所得产物的结构来推断原炔烃的结构。烷基硼烷可以由单取代乙炔通过硼氢化-氧化制备。加成反应式为反马氏,烯基硼烷在碱性过氧化氢中氧化得到烯醇,烯醇异构化成醛。取代二元乙炔通常得到两个酮的混合物。聚合乙炔可以在不同催化剂的作用下选择性聚合成链状或环状化合物。例如,在氯化亚铜或氯化铵的作用下,可以发生二聚或三聚反应生成苯。但该反应中苯的收率很低,同时还产生了许多其他芳香族副产物,没有制备价值,但为研究苯的结构提供了有力的线索。除三聚环状化合物外,乙炔在四氢呋喃中,在1.5 ~ 2 MPa、50的氰化镍催化下聚合,可生成环辛四烯。目前还没有发现环辛四烯有重大的工业应用,但这种化合物在认识芳香族化合物的过程中起着重要的作用。以前认为乙炔在压力下不能反应,因为受压后容易爆炸。后来发现用氮气稀释的乙炔在压力下可以安全反应,从而开辟了乙炔的许多新反应,制备了许多重要的化合物。环辛四烯就是其中之一。在水和高锰酸钾存在下的化学反应,温和条件下:PH=7.5,RCCR" RCO-OCR ",剧烈条件下:100C,RCCR "RC ooh r " cooh chCRCO2 RC ooh炔烃与臭氧反应生成臭氧化物。
将α-二酮氧化成羧酸。 炔烃中C≡C的C是sp杂化,使得Csp-H的σ键的电子云更靠近碳原子,增强了C-H键极性使氢原子容易解离,显示“酸性”。 电负性:sp>sp2>sp3,酸性大小顺序:乙炔>乙烯>乙烷。 连接在C≡C碳原子上的氢原子相当活泼,易被金属取代,生成炔烃金属衍生物叫做炔化物。 CH≡CH + Na → CH≡CNa + 1/2H2↑(条件NH3) CH≡CH + 2Na → CNa≡CNa + H2↑ (条件NH3,190℃~220℃)CH≡CH + NaNH2→ CH≡CNa + NH3↑ CH≡CH + Cu2Cl2(2AgCl) → CCu≡CCu( CAg≡CAg )↓ + 2NH4Cl +2NH3( 注意:只有在三键上含有氢原子时才会发生,用于鉴定端基炔RH≡CH)。炔与带有活泼氢的有机物发生亲核加成反应: 在氯化亚铜催化剂时:CH≡CH + HCN → CH=CH-CN 炔会发生聚合反应:2CH≡CH →CH2=CH-C≡CH (乙烯基乙炔) + CH≡CH →CH2=CH-C≡C-CH=CH2(二乙烯基乙炔)[1] 7测定展示编辑有机分子中的键长可用电子衍射、微波、红外或拉曼光谱予以测定。乙烷、乙烯和乙炔中的碳碳键长和碳氢键长如下所示:乙烯分子中键长乙炔分子中键长乙烷分子中键长上列图片显示,由于π键的出现,使碳碳间的距离缩短,而且三键比双键更短。这是因为随着不饱和度的增大,两个碳原子之间的电子云密度也增大,所以碳原子越来越靠近。上列数字还表明:碳氢化合物中的碳氢键的键长也不是一个常数。这说明:键长除了与成键原子的不饱和度有关外,还和参与成键的碳原子的杂化方式有关。即随着杂化轨道中s成分的增大,碳碳键的键长缩短。乙烷、乙烯和乙炔中的碳原子的s成分分别为25%,33%和50%,从sp3到sp,碳原子的s成分增大了一倍,所以碳碳键的键长越来越短。由于杂化碳原子的s成分不同,丙烷、丙烯、丙炔中的碳碳单键的键长是不等长的,s成分越多,碳碳单键的键长越短,随着键长的缩短,原子间的键能将增大。主要成分:含量:工业级≥97.5%。气味:工业品有使人不愉快的大蒜气味,例如:乙炔,由电石,碳化钙,俗称“臭石”可以制得。化学特性碳氢键的异裂也可以看做是一种酸性电离(ionization),所以将烃称为含碳酸。含碳酸的酸性可用pKa的值来判断,pKa越小,酸性越强。末端炔烃的酸性大于末端烯烃,两者又大于烷烃。这是因为轨道的杂化方式会影响碳原子的电负性。一般来讲,杂化轨道中s成分越大,碳原子的电负性就越大,所以在≡C—H中,形成C—H键的电子对比末端烯烃中C—H键和烷烃中的C—H的电子对更靠近碳原子,导致末端炔烃中的C—H键更易于异裂,释放出质子,因而末端炔烃的酸性比末端烯烃和烷烃强。所以,它们可与强碱反应形成金属化合物,称为炔化物。乙炔一钠中的氢还可以和碱继续反应,生成乙炔二钠。二者皆为弱酸盐,与水作用很快即水解成乙炔和氢氧化钠,但乙炔二钠比乙炔一钠更为激烈,几乎是爆炸性的。乙炔一钠是制备一元取代乙炔,也叫做末端炔烃的重要原料。与烷烃不同,炔烃不稳定并非常活跃,因此乙炔燃烧发出大量的热,乙炔焰常用来焊接。制备炔烃的一般制备是通过邻二卤化烷烃的脱卤化氢作用,也可以通过金属炔化合物与一级卤化烷反应制得。在Fritsch-Buttenberg-Wiechell重排中,炔烃又溴化乙烯基起始制得。炔烃也可以由醛通过Corey-Fuchs反应制得,亦可以通过Seyferth-Gilbert同素化制得。乙炔制作用煤或石油作原料,是生产乙炔的两种主要途径。随着天然气化学工业的发展,天然气即将成为乙炔的主要来源。电弧法甲烷在1500℃电弧中经极短时间(0.1~0.01s)加热,裂解成乙炔,即:2CH4→C2H2+3H2 ΔH=397.4KJ/mol由于乙炔在高温很快分解成碳,故反应气须用水很快地冷却,乙炔产率约15%,改用气流冷却反应气,可提高乙炔产率达25%~30%。裂解气中还含有乙烯、氢和碳尘。这个方法的总特点是原料非常便宜,在天然气丰富的地区采用这个方法是比较经济的。石脑油也可用此方法生产乙炔。[2] 电石法以前这是大工业生产乙炔的唯一方法,即用焦炭和氧化钙经电弧加热至2200℃,制成碳化钙(CaC2),它再与水反应,生成乙炔和氢氧化钙:CaO+3C<—2200℃—>CaC2+CO ΔH=460KJ/molCaC2+2H2O——>C2H2+Ca(OH)2此法成本较高,除少数国家外,均不用此法。等离子法用石油和极热的氢气一起热裂制备乙炔,即把氢气在3500~4000℃的电弧中加热,然后部分等离子化的等离子体氢(正负离子相等)于电弧加热器出口的分离反应室中与气体的或气化了的石油气反应,生成的产物有:乙炔、乙烯(二者的总产率在70%以上)以及甲烷和氢气。乙炔过去是非常重要的有机合成原料,由于乙炔的生产成本相当高,以乙炔为原料生产化学品的路线逐渐被以其他化合物(特别是乙烯、丙烯)为原料的路线所取代。纯的乙炔是带有乙醚气味的气体,具有麻醉作用,燃烧时火焰明亮,可用以照明。工业乙炔不好闻气味是由于含有硫化氢、磷化氢、以及有机磷、硫化合物等杂质引起的。与乙烯、乙烷不同,乙炔在水中具有一定的溶解度,但易溶于丙酮。液化乙炔经碰撞、加热可发生剧烈爆炸,乙炔与空气混合、当它的含量达到3~70%时,会剧烈爆炸。商业上为安全地处理乙炔,把它装入钢瓶中,瓶内装有多孔材料,如硅藻土、浮石或木炭,再装入丙酮。丙酮在常压下,约可溶解相当于它体积25倍的乙炔,而在1.2MPa下可溶解相当其体积300倍的乙炔。乙炔和氧气混合燃烧,可产生2800℃的高温,用以焊接或切割钢铁及其他金属。8应用编辑制氯乙烯,氧炔焰。提纯上述炔化物干燥后,经撞击会发生强烈爆炸,生成金属和碳。故在反应完了时,应加入稀硝酸使之分解。另外,由于氰负离子和银可形成极稳定的络合物,再去炔化银中加入氰化钠水溶液可得回炔烃。如:RC≡CAg+2CN-+H2O→RC≡CH+Ag(CN)2- +OH-也可以通过这个反应提纯末端炔烃。卤化末端炔烃与次卤酸反应,可以得到炔基卤化物。RC≡CH+HOBr→RC≡CBr+H2O末端炔烃与醛、酮的反应。乙炔及末端炔烃在碱的催化下,可形成炔碳负离子,作为亲核试剂与羰基进行亲核加成,生成炔醇。还原催化加氢 在常用催化剂钯、铂或镍的作用下,炔烃与2 mol H2加成,生成烷烃。中间产物难以分离得到。若用Lindlar(林德拉)催化剂(钯附着于碳酸钙及小量氧化铅上,使催化剂活性降低)进行炔烃的催化氢化反应,则炔烃只加 1 mol H2得Z型烯烃。例如:一个天然的含三键的硬脂炔酸,在该催化剂作用下,生成与天然的顺型油酸完全相同的产物。用硫酸钡作载体的钯催化剂在吡啶中也可以使碳碳三键化合物只加 1 mol H2,生成顺型的烯烃衍生物。这表明,催化剂的活性对催化加氢的产物有决定性的影响。炔烃的催化加氢是制备Z型烯烃的重要方法,在合成中有广泛的用途。硼氢化—炔烃与乙硼烷反应生成烯基硼烷,烯基硼烷与醋酸反应,生成Z型烯烃。第一步反应是炔烃的硼氢化反应,第二步反应是烯基硼的还原反应,总称硼氢化—还原反应。碱金属还原 炔类化合物在液氨中用金属钠还原,主要生成E型烯烃衍生物。氢化铝锂还原 炔烃用氢化铝锂还原也能得到E型烯烃。9加成反应编辑亲电加成乙炔及其取代物与烯烃相似,也可以发生亲电加成反应,但由于sp碳原子的电负性比sp2碳原子的电负性强,使电子与sp碳原子结合得更为紧密,尽管三键比双键多一对电子,也不容易给出电子与亲电试剂结合,因而使三键的亲电加成反应比双键的亲电加成反应慢。乙炔及其衍生物可以和两分子亲电试剂反应。先是与一分子试剂反应,生成烯烃的衍生物,然后再与另一分子试剂反应,生成饱和的化合物。不对称试剂和炔烃加成时,也遵循马氏规则,多数加成是反式加成。和卤素的加成卤素和炔烃的加成为反式加成。反应机理与卤素和烯烃的加成相似,但反应一般较烯烃难。例如,烯烃可使溴的四氯化碳溶液立刻褪色,炔烃却需要几分钟才能使之褪色。故分子中同时存在非共轭的双键和叁键,在它与溴反应时,首先进行的是双键的加成。又如,乙炔与氯的加成反应须在光或三氯化铁或氯化亚锡的催化作用下进行,中间产物为反二氯乙烯,最后产物为1,1,2,2-四氯乙烷(CHCl2CHCl2)。和氢卤酸的加成炔烃和氢卤酸的加成反应是分两步进行的,选择合适的反应条件,反应可控制在第一步。这也是制卤化烯的一种方法。一元取代乙炔与氢卤酸的加成反应遵循马氏规则。当炔键两侧都有取代基时,需要比较两者的共轭效应和诱导效应,来决定反应的区域选择性,但一般得到的是两种异构体的混合物。和水加成炔烃和水的加成常用汞盐作催化剂。例如,乙炔和水的加成是在10%硫酸和5%硫酸亚汞水溶液中发生的。水先与三键加成,生成一个很不稳定的加成物——乙烯醇[羟基直接和双键碳原子相连的化合物称为烯醇]。乙烯醇很快发生异构化,形成稳定的羰基化合物。炔烃与水的加成遵循马氏规则,因此除乙炔外,所有的取代乙炔和水的加成物都是酮,但一元取代乙炔与水的加成物为甲基酮,二元取代乙炔的加水产物通常是两种酮的混合物。自由基有过氧化物存在时,炔烃和溴化氢发生自由基加成反应,得反马氏规则的产物。和氢氰酸加成氢氰酸可与乙炔发生亲核加成反应。反应中CN-受限于三键进行亲核加成形成碳负离子,再与质子作用,完成生成丙烯腈的反应。上法因乙炔成本较高,现世界上几乎都采用丙烯的氨氧化反应制丙烯腈,反应过程是丙烯与氨的混合物在400~500℃,在催化的作用下用空气氧化。聚丙烯腈可用于合成纤维(腈纶)、塑料、丁腈橡胶。此外,丙烯腈电解加氢二聚,是一个新的成功合成己二腈的方法。己二腈加氢得己二胺,己二腈水解得己二酸,是制造尼龙-66的原料。和氢加成乙炔或其一元取代物可与带有下列“活泼氢”的有机物,如—OH,—SH,—NH2,=NH,—CONH2或—COOH发生加成反应,生成含有双键的产物。例如乙醇在碱催化下于150~180℃,0.1~1.5MPa下与乙炔反应,生成乙烯基乙醚。根据原料的不同,反应条件(即温度、压力i、催化剂等)也可以不同。这类反应的反应机理是烷氧负离子与三键进行亲核加成,产生一个碳负离子中间体,碳负离子中间体从醇分子中得到质子,得产物。乙烯基乙醚聚合后的聚乙烯基乙醚,常用作黏合剂。氧化炔烃经臭氧或高锰酸钾氧化,可发生碳碳三键的断裂,生成两个羧酸。二卤代烷邻二卤代烷和间二卤代烷在碱性实际点作用下失去两分子卤化氢生成炔烃。常用的碱性试剂有氢氧化钠或氢氧化钾的醇溶液和氨基钠的矿物油。末端烯烃乙炔与NaNH2(KNH2、LiNH2均可)在液氨中形成乙炔化钠,然后与卤代烷发生SN2反应,形成一元取代乙炔。卤代烷以一级最好,β位有侧链的以及卤代烷及二级、三级卤代烷易发生消除反应,不能用于合成。一元取代乙炔可进一步用于合成二元取代乙炔。末端烯烃直接氧化偶联可用来制作高级炔烃。注意事项:1、乙炔与烷烃不同,炔烃不稳定且非常活跃,乙炔燃烧发出大量的热,乙炔焰常被用来焊接。2、炔化物干燥后,经撞击而发生强烈爆炸,生成金属和碳。故在反应完了时,应加入稀硝酸使之分解。3、氰负离子和银可形成极稳定的络合物,再去炔化银中加入氰化钠水溶液可得回炔烃。4、乙炔不稳定、非常活跃。乙炔储存要避免受热。5、乙炔禁配强氧化剂、强酸、卤素。6、乙炔与空气混合,能形成爆炸性混合物,遇明火、高热能引起燃烧、爆炸。与氧化剂接触猛烈反应。与氟、氯等接触会发生剧烈的化学反应 能与铜、银、汞等的化合物生成爆炸性物质。
炔烃的特性
相对蒸气密度:(空气=1):0.91。蒸气压(kPa):4053(16.8℃)。闪点<-50℃。燃烧热:1298.4kJ/mol键能:837kJ/mol稳定性和反应活性:不稳定、非常活跃 。禁配物:强氧化剂、强酸、卤素。避免接触的条件:受热。危险特性:极易燃烧爆炸。与空气混合能形成爆炸性混合物,遇明火、高热能引起燃烧爆炸。与氧化剂接触猛烈反应。与氟、氯等接触会发生剧烈的化学反应。能与铜、银、汞等的化合物生成爆炸性物质。溶解性:微溶于乙醇,溶于丙酮、氯仿、苯。简单炔烃的沸点、熔点以及密度,一般比碳原子数相同的烷烃和烯烃要高一些。这是由于炔烃分子较短小、细长,在液态和固态中,分子可以彼此很靠近,分子间的范德华力(van der Waals作用力)很强。炔烃分子略极性比烯烃强。烯烃不易溶于水,而易溶于石油醚、乙醚、苯和四氯化碳中。一些炔烃的名称及物理性质列入下表: 一些常见炔烃的名称及物理性质化合物 熔点/℃ 沸点/℃ 相对密度 乙炔 -82(在压力下) -82(升华) — 丙炔 -102.5 -23 — 1-丁炔 -122 8 — 1-戊炔 -98 40 0.695 1-己炔 -124 71 0.719 1-庚炔 -80 100 0.733 1-辛炔 -70 126 0.747 2-丁炔 -24 27 0.694 2-戊炔 -101 56 0.714 2-己炔 -88 84 0.730 3-己炔 -105 81 0.725 将乙炔通入银氨溶液或亚铜氨溶液中,则分别析出白色和红棕色炔化物沉淀。其他末端炔烃也会发生上述反应,因此可通过以上反应,可以鉴别出分子中含有的—C≡CH基团。和炔烃的氧化一样,根据高锰酸钾溶液的颜色变化可以鉴别炔烃,根据所得产物的结构可推知原炔烃的结构。一元取代乙炔通过硼氢化—氧化可制得烯基硼烷,该加成反应式反马氏规则的,烯基硼烷在碱性过氧化氢中氧化,得烯醇,异构化后生成醛。二元取代乙炔,通常得到两种酮的混合物。聚合乙炔在不同的催化剂作用下,可有选择地聚合成链形或环状化合物。例如在氯化亚铜或氯化铵的作用下,可以发生二聚或三聚作用,生成苯。但这个反应苯的产量很低,同时还产生许多其他的芳香族副产物,因而没有制备价值,但为研究苯的结构提供了有力的线索。除了三聚环状物外,乙炔在四氢呋喃中,经氰化镍催化,于1.5~2MPa、50℃时聚合,可产生环辛四烯。目前尚未发现环辛四烯的重大工业用途,但该化合物在认识芳香族化合物的过程中,起着很大的作用。以往认为乙炔不能在加压下进行反应,因为它受压后,很容易爆炸。后来发现将乙炔用氮气稀释,可以安全地在加压下进行反应,因而开辟了乙炔的许多新型反应,制备出许多重要的化合物。环辛四烯就是其中一个。 在水和高锰酸钾存在的条件下,温和条件: PH=7.5时, RC≡CR" → RCO-OCR" 剧烈条件:100°C时,RC≡CR" → RCOOH + R"COOH CH≡CR →CO2+ RCOOH炔烃与臭氧发生反应,生成臭氧化物,后者水解生成α—二酮和过氧化物,随后过氧化物将α-二酮氧化成羧酸。 炔烃中C≡C的C是sp杂化,使得Csp-H的σ键的电子云更靠近碳原子,增强了C-H键极性使氢原子容易解离,显示“酸性”。 电负性:sp>sp2>sp3,酸性大小顺序:乙炔>乙烯>乙烷。 连接在C≡C碳原子上的氢原子相当活泼,易被金属取代,生成炔烃金属衍生物叫做炔化物。 CH≡CH + Na → CH≡CNa + 1/2H2↑(条件NH3) CH≡CH + 2Na → CNa≡CNa + H2↑ (条件NH3,190℃~220℃)CH≡CH + NaNH2→ CH≡CNa + NH3↑ CH≡CH + Cu2Cl2(2AgCl) → CCu≡CCu( CAg≡CAg )↓ + 2NH4Cl +2NH3( 注意:只有在三键上含有氢原子时才会发生,用于鉴定端基炔RH≡CH)。炔与带有活泼氢的有机物发生亲核加成反应: 在氯化亚铜催化剂时:CH≡CH + HCN → CH=CH-CN 炔会发生聚合反应:2CH≡CH →CH2=CH-C≡CH (乙烯基乙炔) + CH≡CH →CH2=CH-C≡C-CH=CH2(二乙烯基乙炔)
什么是乙稀和什么是乙炔
答:乙稀 乙烯的化学式是C2H4 ,结构是每一个碳原子连接两个氢原子,形成碳氢单键,两个碳原子之间是一个双键。这个双键可以和氢气、水或者氯素单质、氯化氢发生加成反应。物理特性:在常温下,为无色易燃气体, 略具烃特有的臭味. 不溶于水, 微溶于醇, ,酮,苯, 溶于醚. 凝固点:-181℃ 熔点:-169.4℃ 沸点:-103.9℃ 闪点:-136℃ 自燃点:490℃ 爆炸极限:2.7%~36% 产生最大爆炸压力的浓度:8.0% 最大爆炸压力:87.3牛/厘米 。 乙炔化学式是C2H2 ,结构是每一个碳原子连接一个氢原子,形成碳氢单键,两个碳原子之间是一个三键,这个三键可以和氢气、水或者氯素单质、氯化氢发生加成反应。纯净的乙炔是无色、无臭的气体。但用电石在一般情况下制取的乙炔,常带有一种令人极不愉快的恶臭,这是由于在电石中含有少量硫化钙、砷化钙、磷化钙等杂质的缘故。当这些杂质与水作用时,生成了带有特殊臭味的硫化氢、砷化氢和磷化氢气体。CaS+2H2O→Ca(OH)2+H2S↑Ca3AS2+6H2O→3Ca(OH)2+2AsH3↑Ca3P2+6H2O→3Ca(OH)2+2PH3↑将用电石制取的乙炔气体通入盛有重铬酸钾的浓硫酸溶液,或氯化汞的稀盐酸溶液,或碱溶液的洗气瓶,都可以除去这些带有臭味的气体,得到较纯净的乙炔。 乙炔的爆炸乙炔与空气能形成爆炸性的混合物。乙炔在空气中的爆炸极限是3%~81%(体积分数)。从乙炔的爆炸极限中可以看出,乙炔构成的爆炸混合物的组成范围比其他烃类要大得多。乙炔不仅能与空气形成爆炸混合物,在受到外界的压力时也不稳定。液态乙炔受到震动时就会分解,发生爆炸,并放出大量的热。CH≡CH→2C+H2 ΔH=-214.4 kJ/mol乙炔在燃烧时发出明亮的火焰,这是由于在燃烧时有一部分碳氢化合物裂化成细微分散的碳颗粒,这些微小的碳粒受到灼热而发出光。所以,乙炔曾作为照明气使用。3.乙炔与高锰酸钾溶液的反应乙炔与乙烯一样,都能被高锰酸钾等氧化剂所氧化,氧化的最终产物是二氧化碳。3CH≡CH+10KMnO4+2H2O→6CO2↑+10KOH+10MnO2↓4.乙炔的加成反应乙炔在结构上的特点是具有C≡C三键,它跟烯烃一样,能与卤素、卤化氢、H2SO4等发生加成反应,反应历程也相似,都属于亲电加成反应。但是,乙炔与上述亲电试剂的加成反应要比乙烯困难一些,反应的速率也要慢一些。例如,乙炔与溴水反应比乙烯与溴水的反应要慢。将乙烯通入溴水,很快就会使溴水褪色,这方面的实验事实往往会使人们感到不易理解。从表面上看,乙炔分子中有两个π键,而乙烯分子中只含有一个π键。因此,人们常常会错误地认为:由于乙炔比乙烯的不饱和程度高,乙炔应该比乙烯更活泼,更容易发生加成反应。从数量上看,乙炔分子确实比乙烯分子多一个π键,但要从π键的强度来看,乙炔分子中的π键的强度要比乙烯分子中π键的强度大。因此,乙炔分子中的π键在发生加成反应时不易断裂,反应速率也就显得较慢。这样的结果是由于乙烯分子和乙炔分子中碳原子的杂化轨道的不同而引起的。虽然在乙烯和乙炔的分子中都具有π键,但在乙炔分子中,碳原子是以sp杂化轨道成键的。由于sp杂化轨道中的s电子成分比sp2杂化轨道中的s电子成分多,使得碳碳键的键长变短(在乙烯分子中,C=C的键长为0.134 nm;在乙炔分子中,C≡C的键长为0.120 nm),这就意味着乙炔分子中的两个p轨道侧面重叠较多。我们知道,键的强度与电子云重叠的程度有关。重叠程度越大,键的强度也越大。因此,乙炔分子中π键的强度要比乙烯分子中π键的强度大。乙炔的弱酸性 在有机化学中,我们通常研究到一类物质的酸性。虽然它们并不能使酸碱指示剂变色,也不能中和碱溶液,但它们有失去H+的趋势。乙炔和其他炔烃就是这样一类物质。例如,将乙炔通入银氨溶液或亚铜氨溶液中,会分别析出白色的乙炔银和红棕色的乙炔亚铜沉淀。在这两个反应中,乙炔中的氢原子脱离乙炔分子而成为氢离子,氢离子与NH3结合生成NH+4。乙炔银和乙炔亚铜都是炔化物,碳化钙也是一种炔化物。 乙炔之所以具有这样的性质,一般都认为是因为乙炔分子中的碳原子是sp杂化,杂化中含有s电子和p电子。sp杂化时碳的电负性大于sp2杂化和sp3杂化。所以,与三键碳原子结合的氢原子比较容易脱去而显一定的弱酸性。
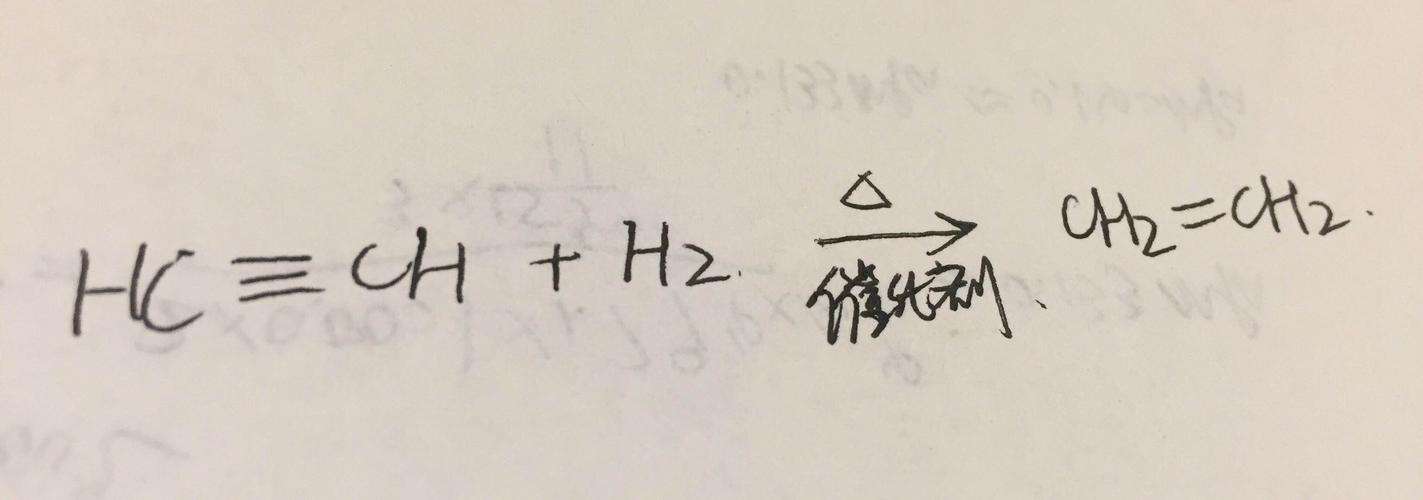
上一篇:乙炔(氧气瓶防震圈和安全帽)
下一篇:乙烯基乙炔(烯烃和羧酸怎么反应)
- 人参与,0条评论
发表评论